Resumen
La Agencia Nacional para la Seguridad de los Medicamentos y Productos Sanitarios (ANSM) ha creado el registro de grupos híbridos.
Este documento de referencia permite regular la sustitución en farmacia entre un medicamento de referencia y un medicamento híbrido.
Esta primera versión incluye 9 grupos de medicamentos para enfermedades obstructivas de las vías respiratorias administrados por vía inhalatoria, cuyos referentes son:
- INNOVAIR 100/6 microgramos/dosis solución para inhalación en frasco presurizado
- FLIXOTIDE 125 y 250 microgramos/dosis suspensión para inhalación en vial presurizado
- SERETIDE DISKUS 100 microgramos/50 microgramos/dosis, 250 microgramos/50 microgramos/dosis y 500 microgramos/50 microgramos/dosis polvo para inhalación en envase unidosis
- SERETIDE 125 microgramos/25 microgramos/dosis y 250 microgramos/25 microgramos/dosis suspensión para inhalación en frasco presurizado con válvula dosificadora
- SPIRIVA 18 microgramos, polvo para inhalación en cápsulas
Para todos estos grupos, la sustitución por parte del farmacéutico es posible en todas las situaciones médicas, previa indicación de exclusión fijada por el prescriptor en la receta. La exclusión de sustitución por parte del prescriptor se regula reglamentariamente.
Cuando se sustituya la especialidad prescrita por su versión híbrida, el farmacéutico deberá informar al paciente.
contrade conformidad con el artículo L5121-10 del Código de Salud Pública (ver. En caja), la Agencia Nacional para la Seguridad de los Medicamentos y Productos Sanitarios (ANSM) ha creado el registro de grupos híbridos [1, 2].
Allí se enumeran los primeros nueve grupos de medicamentos híbridos; Pertenecen a las clases de medicamentos para enfermedades obstructivas de las vías respiratorias que se administran por inhalación (ver. nuestro artículo del 26 de noviembre de 2019, actualizado el 14 de abril de 2022).
| (…) Para las especialidades híbridas, se crea un registro de grupos híbridos que incluye los grupos en los que se agrupa una especialidad de referencia y las especialidades que son híbridas. |
Sustitución por un fármaco híbrido: el sistema regulatorio está completo
Inicialmente prevista para 2020, la creación del registro de grupos de medicamentos híbridos es el último paso regulatorio necesario para la implementación efectiva de la sustitución en farmacia entre medicamentos de un mismo grupo híbrido.
El sistema normativo que organiza, por un lado, el reconocimiento de los medicamentos híbridos en el derecho francés y, por otro, el derecho de sustitución por parte del farmacéutico, se basa en los siguientes artículos y textos:
- El artículo L5121-1 del Código de Salud Pública (CSP) define la especialidad híbrida como una “ especialidad que no cumple con la definición de especialidad genérica porque contiene diferencias con la especialidad de referencia en cuanto a indicaciones terapéuticas, posología, forma farmacéutica o vía de administración, o cuando la bioequivalencia comparada con esta especialidad de referencia no pudo demostrarse mediante estudios de biodisponibilidad » ;
- el artículo L5121-10 del CSP prevé la creación de un registro de grupos híbridos;
- el artículo L5125-23 del CSP define el marco de sustitución por parte del farmacéutico comunitario, es decir, las condiciones que autorizan la sustitución o excluyen esta posibilidad;
- un decreto del 31 de enero de 2023 fija (ver. nuestro artículo del 7 de febrero de 2023):
- situaciones médicas en las que los prescriptores pueden excluir la sustitución de la especialidad prescrita por una especialidad del mismo grupo híbrido (clases R03A y B),
- los métodos que deberán implementar para indicar la exclusión de cualquier sustitución;
Presentación del registro de grupos híbridos
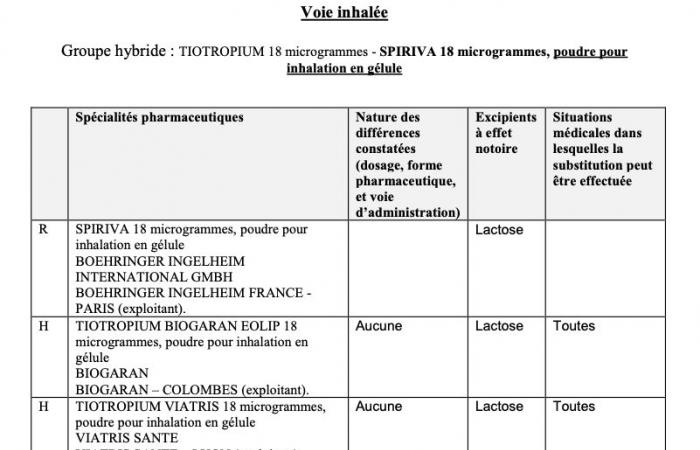
El registro de grupos híbridos supervisa y garantiza la sustitución en las farmacias comunitarias de los medicamentos de referencia por medicamentos híbridos registrados dentro de cada grupo. Para cada grupo se detallan los siguientes elementos (ver. Dibujo):
- estatus de la especialidad: referente o híbrido;
- nombre de especialidades;
- naturaleza de las diferencias observadas (dosificación, forma farmacéutica, vía de administración);
- Excipientes con efecto conocido;
- situaciones médicas en las que se puede realizar la sustitución.
Ilustración – Extracto del registro de grupos híbridos.
Antes de cada inscripción en este registro, la ANSM evalúa la sustituibilidad o no del medicamento híbrido, respecto al medicamento de referencia. De lo contrario, no aparecerá como parte de un grupo en el registro.
Al igual que el de los genéricos, este registro de grupos híbridos se puede consultar online en el sitio web de la ANSM.
Primeros nueve grupos creados
De acuerdo con el decreto del 14 de abril de 2022, los primeros nueve grupos creados en el registro de grupos híbridos corresponden a medicamentos inhalados indicados para enfermedades obstructivas de las vías respiratorias. [3] :
- grupos PROPIONATO DE FLUTICASONA suspensión para inhalación en frasco presurizado:
- grupos PROPIONATO DE FLUTICASONA / SALMETEROL polvo para inhalación en envase unidosis:
- grupos PROPIONATO DE FLUTICASONA / SALMETEROL suspensión para inhalación en frasco presurizado:
Algunas de las especialidades híbridas enumeradas en estos grupos ya se comercializan a 24 de abril de 2024.
“A medida que el decreto del 12 de abril de 2022 se amplíe a nuevas clases de medicamentos, el registro se enriquecerá con nuevos grupos de medicamentos híbridos, sujeto a la evaluación de estos medicamentos y de su sustituibilidad, previa consulta con los profesionales sanitarios y las asociaciones de pacientes interesadas”indica la ANSM.
Sustitución dentro de grupos híbridos en la práctica.
El dispensador (farmacéutico o preparador de farmacia) puede sustituir un medicamento por su versión híbrida:
- si estos medicamentos están inscritos en el mismo grupo dentro del registro, y respetando las posibles restricciones relativas a la situación médica: para los 9 grupos actualmente registrados (medicamentos para enfermedades obstructivas de las vías respiratorias), no hay restricciones en términos de situación médica;
- si el prescriptor no ha excluido la sustitución en la prescripción.
Situaciones para las cuales el prescriptor puede excluir el uso de una sustitución
Las situaciones de exclusión de sustitución por parte del prescriptor, previstas por el CSP, son las siguientes:
- prescripción para niños menores de 6 años, cuando ninguna especialidad del mismo grupo híbrido inscrita en el registro de grupos híbridos tenga forma farmacéutica adecuada y la especialidad de referencia disponible permita esta administración;
- prescripción a un paciente que presente una contraindicación formal y demostrada a un excipiente de efecto conocido presente en todas las especialidades disponibles de un mismo grupo híbrido inscrito en el registro de grupos híbridos cuando la especialidad de referencia correspondiente no incluya este excipiente.
En estos casos, si el prescriptor excluye el uso de sustitución con un híbrido, deberá indicarlo en la receta mediante mención expresa:
- la mención “no sustituibles (EFG)”para la prescripción de una formulación adecuada para la administración en niños menores de 6 años;
- la mención “no sustituibles (CIF)”, en caso de contraindicación para un excipiente con efecto conocido.
Información del paciente
Al dispensar un medicamento híbrido en sustitución de un medicamento de referencia, el farmacéutico tiene la obligación de informar al paciente.