⇧ [VIDÉO] También te puede gustar el contenido de este socio.
Los investigadores han desarrollado un compuesto que sirve como “pegamento molecular” para dos proteínas que, cuando se combinan, activan el proceso natural de autodestrucción (o apoptosis) de las células cancerosas. Esta estrategia se diferencia de otras terapias celulares tanto por su alta especificidad como por su capacidad para activar un proceso molecular desactivado por el cáncer. El compuesto mostró resultados prometedores en ensayos con células de linfoma difuso de células B grandes.
Cada día, nuestro cuerpo elimina aproximadamente 60 mil millones de células mediante un proceso de muerte celular programada, conocido como apoptosis. Este mecanismo es esencial para la renovación celular natural (especialmente las células sanguíneas e intestinales) y desempeña un papel clave en muchos procesos biológicos, como la función de los órganos y la regulación del sistema inmunológico. Es altamente selectivo, destruyendo sólo las células no esenciales, mientras retiene aquellas que reconocen patógenos, evitando así enfermedades autoinmunes.
La apoptosis ha despertado un interés considerable en las terapias contra el cáncer debido a esta especificidad. De hecho, los tratamientos tradicionales, como la quimioterapia y la radioterapia, atacan tanto a las células sanas como a las cancerosas, volviéndolas muy tóxicas. El equipo de la Universidad de Stanford propone una estrategia innovadora que aprovecha la especificidad de la apoptosis para atacar exclusivamente las células cancerosas.
« Este era el camino que queríamos tomar para tratar el cáncer », explica Gérald Crabtree, coautor principal del estudio publicado en la revista Cienciaen una publicación del blog de Stanford Medicine. “ Queremos reproducir esta especificidad que elimina 60 mil millones de células sin daños colaterales, asegurando que ninguna célula sea destruida si no es el objetivo adecuado. », añade.
Un enfoque que contrasta con las terapias celulares tradicionales
Para aprovechar la apoptosis y matar las células cancerosas, los investigadores diseñaron un inductor de proximidad química (CIP) de molécula pequeña. Este último actúa como un pegamento molecular, permitiendo juntar y asociar dos moléculas que normalmente no se unirían. La hipótesis planteada por el equipo es que CIP podría transformar los inhibidores de quinasas en activadores de estados transcripcionales epigenéticamente silenciosos. En otras palabras, se trata de activar una vía molecular normalmente desactivada en las células cancerosas, a diferencia de enfoques anteriores que tenían como objetivo desactivar factores oncogénicos específicos.
« Desde el descubrimiento de los oncogenes, los investigadores han intentado neutralizarlos en el cáncer », subraya Roman Sarott de Stanford Medicine, también coautor del estudio. “ Más bien, estamos intentando utilizarlos para activar señales potencialmente beneficiosas para el tratamiento. ».
Se desarrolló un CIP para unir la proteína BCL6 a la proteína quinasa CDK9. BCL6, una proteína oncogénica, está implicada en entre el 40 y el 60% de los casos de linfoma difuso de células B grandes, a menudo mediante mutación, sobreexpresión o desregulación. La mutación de BCL6 desactiva la apoptosis en las células cancerosas al unirse a los genes responsables del proceso, permitiendo así la proliferación tumoral. CDK9, por su parte, activa estos genes. CIP combina estas dos moléculas y las guía hacia los genes diana. “ Utilizan un elemento esencial para la supervivencia del cáncer para revertir la situación y destruirla », Explica Nathanael Gray, participante del estudio.
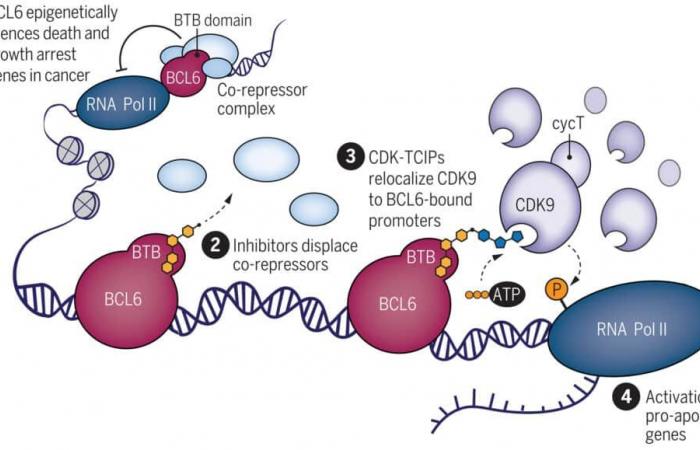
Diagrama que ilustra el mecanismo de acción del pegamento molecular. El factor de transcripción BCL6 interactúa con correpresores epigenéticos para regular la muerte y proliferación celular en el linfoma. Las moléculas bivalentes resultantes redirigieron CDK9 y su actividad a sitios regulados por BCL6, activando así la muerte celular. © Roman Sarott et al.
Una eficacia cien veces mayor en comparación con terapias anteriores
Se realizaron ensayos en células de linfoma humano difuso de células B grandes para identificar los complejos CKD9-CIP-BCL6 de mejor rendimiento. El compuesto se probó en 859 tipos de células cancerosas y mostró una eliminación eficaz de las células malignas. Los complejos más eficaces mostraron una eficacia 100 veces mayor que los compuestos dirigidos únicamente a CDK9 o BCL6, en concentraciones subnanomolares.
Ver también


Las pruebas en ratones sanos no revelaron efectos secundarios importantes. Sin embargo, el compuesto también afectó a las células B sanas, y estas células inmunitarias también están reguladas por BCL6. Se descubrió que el compuesto era 200 veces menos tóxico para las células B sanas que para las células cancerosas.
Dado que BCL6 regula 13 genes implicados en la apoptosis, los expertos creen que esta terapia podría ser eficaz para los cánceres resistentes al tratamiento. Las células tumorales desarrollan rápidamente tolerancia a las terapias dirigidas a un único factor oncogénico. Algunos detienen el crecimiento del tumor sin eliminar por completo las células cancerosas. El equipo cree que al atacar múltiples vías apoptóticas, el tumor no sobreviviría el tiempo suficiente para desarrollar resistencia, aunque esta hipótesis aún debe probarse.
El siguiente paso es probar el compuesto en modelos de ratón de linfoma difuso de células B grandes, para recopilar datos preclínicos para futuros ensayos clínicos. Los investigadores también planean explorar otras moléculas similares dirigidas a otras proteínas oncogénicas, como Ras, implicada en varias formas de cáncer.